Actualidad
Avances en biocontrol de la antracnosis de la fresa
Colletotrichum gloeosporioides, organismo causal de la antracnosis de la fresa, puede controlarse mediante compuestos orgánicos volátiles liberados por Burkholderia sola NAU20
La fresa (Fragaria × ananassa familia Rosaceae) se cultiva en todo el mundo y se considera una fruta de agradable sabor y de alto valor nutricional (abundantes vitaminas, aminoácidos, fibra dietética y minerales esenciales). Sin embargo, debido a los daños físicos durante el transporte como la pérdida de agua y el deterioro microbiológico, la vida útil poscosecha de las fresas se acorta significativamente, lo que resulta en pérdidas económicas sustanciales en toda la cadena de suministro de las frutas frescas.
La antracnosis de la fresa, una grave enfermedad fúngica poscosecha, causa una reducción del 25% al 30% en su producción cada año, lo que afecta de forma muy importante tanto la producción como la calidad.
Las investigaciones indican que la antracnosis es causada principalmente por el hongo Colletotrichum gloeosporioides (Ascomycota) siendo especialmente difícil de controlar durante el cultivo y la cosecha de la fruta.
Tradicionalmente, los fungicidas sintéticos como procloraz, iprodiona, carbendazim y tebuconazol, han sido el principal método para controlar las enfermedades fúngicas en las fresas. Pero estos productos alteran el equilibrio ecológico, contribuyen al aumento de patógenos resistentes y presentan posibles riesgos de toxicidad a largo plazo para la salud humana. Por lo tanto, existe una creciente demanda de nuevos productos seguros y eficaces para el medio ambiente.
Biocontrol como estrategia
Numerosos estudios han demostrado que los agentes de control biológico como microorganismos antagonistas, extractos vegetales, y otros compuestos bioactivos, son eficaces en el manejo de enfermedades fúngicas.
Los mecanismos por los cuales los microorganismos antagonistas inhiben a los hongos patógenos incluyen principalmente la competencia por nutrientes y recursos espaciales, la inducción de resistencia sistémica en plantas o frutos, la producción de enzimas que degradan la pared celular fúngica y la síntesis de metabolitos secundarios con actividad antimicrobiana.
Las actinobacterias, en particular, han recibido considerable atención por sus notables propiedades antifúngicas. Por ejemplo, sustancias como kasugamicina y la validamicina (antibióticos aminoglucósidos), aisladas de Streptomyces kasugaensis y S. hygroscopicus var. limoneus, se han aplicado para controlar el tizón del arroz.
Otros microorganismos antagónicos, como la mixobacteria Corallococcus sp., pueden inhibir eficazmente el crecimiento de Fusarium oxysporum y Magnaporthe oryzae mediante la secreción de la enzima β-1,6-glucanasa, que degrada la pared celular fúngica.
En comparación con los fungicidas sintéticos, los compuestos orgánicos volátiles derivados de los agentes de control biológico son más seguros para la salud de los consumidores, ya que interactúan con los hongos solo en la superficie de las frutas, sin permear el interior, y han demostrado un potencial significativo para el control eficaz de hongos fitopatógenos después de la cosecha.
Por ejemplo, el 2-etilhexanol, un compuesto orgánico volátil producido por Stenotrophomonas sp. NAU1697, actúa sobre Fusarium spp. De manera similar, se han identificado diversos compuestos orgánicos volátiles antimicrobianos, como isooctanol, 2-etilhexanol, 2-nonanona, 4-metoxiestireno y (2E)-dodecenal, a partir de Corallococcus sp., demostrando su actividad antifúngica.
Compuestos orgánicos volátiles de Burkholderia
Las especies Gram-negativas de Burkholderia se han convertido en valiosos recursos promotores del crecimiento vegetal, capaces de fijar nitrógeno y producir fitohormonas. Además, generan diversos metabolitos, incluyendo metabolitos secundarios y compuestos orgánicos volátiles, con propiedades antifúngicas o antibacterianas.
Se ha demostrado que los compuestos orgánicos volátiles producidos por B. cenocepacia ETR-B22 inhiben el crecimiento micelial y la germinación conidial del patógeno Botrytis cinerea, lo que finalmente provoca la destrucción de sus hifas.
De igual manera, B. gladioli MB39, aislada de muestras antárticas, mostró una fuerte actividad antifúngica contra Penicillium digitatum y Macrophomina phaseolina, reduciendo eficazmente el crecimiento hifal y alterando la morfología celular.
Control de C. gloeosporioides por B. sola NAU20
En una investigación reciente se aisló la bacteria Burkholderia sola NAU20 de tejidos de raíces de sorgo con el fin de estudiar su capacidad fijadora de nitrógeno. Sin embargo, experimentos posteriores revelaron que la cepa NAU20 exhibe una actividad antifúngica de amplio espectro, en particular contra C. gloeosporioides.
Por lo tanto, se evaluó la actividad antifúngica de los compuestos orgánicos volátiles liberados por NAU20 contra C. gloeosporioides y se identificaron los principales componentes con actividad antifúngica.
El compuesto etil trans-2-octenoato demostró la actividad antifúngica más potente entre los compuestos orgánicos volátiles analizados, con una concentración mínima inhibitoria (CMI) de 0,448 ml⁻¹.
También, durante este trabajo se estudió el mecanismo molecular de los compuestos orgánicos volátiles contra C. gloeosporioides y se invetigó sus posibles aplicaciones en la conservación de fresas.
Se analizaron los perfiles metabólicos de las fresas tras el tratamiento con compuestos orgánicos volátiles para comprender mejor el mecanismo antifúngico del componente bioactivo.
Mecanismos de acción
Se observó que el crecimiento de hifas y la germinación de conidios de Colletotrichum gloeosporioides se inhiben significativamente mediante compuestos volátiles producidos por Burkholderia sola NAU20.
La estructura de la pared celular fúngica se vio gravemente alterada, y una acumulación significativa de ROS y fragmentación del ADN indica que se podría inducir apoptosis en células tratadas con etil trans-2-octenoato. Este compuesto puede inhibir completamente la infección de C. gloeosporioides en fresas a un nivel de 2×CMI en 5 días.
Además, del efecto antifúngico directo del etil trans-2-octenoato, la inducción de la biosíntesis de fenilpropanoides y flavonoides mejoró la supresión de la infección fúngica.
Estos hallazgos ofrecen un posible avance en el manejo de la antracnosis en fresas después de la cosecha, presentando una solución eficaz para el control de enfermedades en la fruta almacenada.
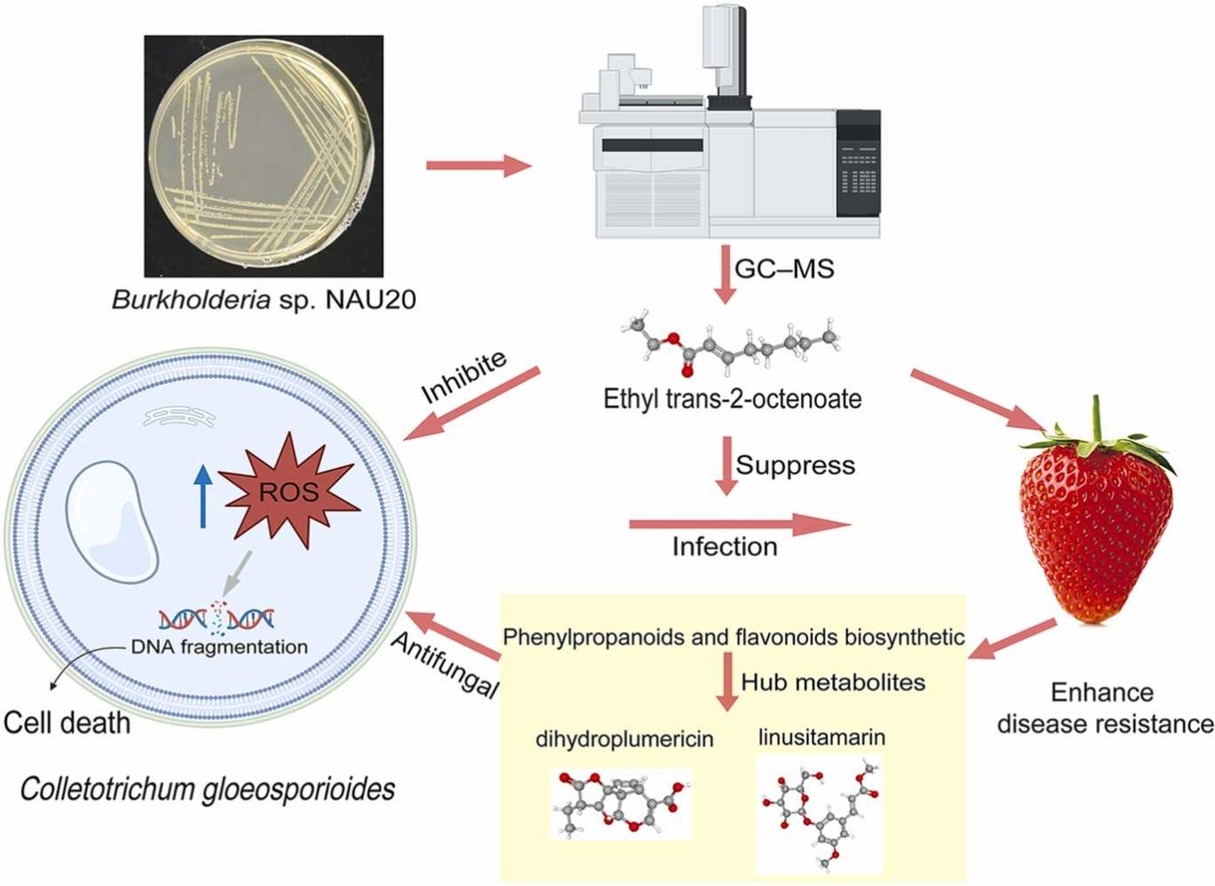
Resumen gráfico según Wang, D. et al, 2025.
Fuentes
Wang, D.; Geng, Z.; Shen, J.; Xie, T.; Wu, F.; Zhang, Y.; Dong, Y.; Mao, D.; Ji, Y.; Huang, Y.; Li, Z.; Liang, Y.; Ye, X.; Cui, Z. (2025).
Biocontrol effects of volatile organic compounds released from Burkholderia sola NAU20 to strawberry anthracnose caused by Colletotrichum gloeosporioides
Postharvest Biology and Technology, 225: 113510.
Imagen
https://www.syngenta.pt/problemas/doencas/antracnose-em-morangueiro
Acceso el 25/03/2025.







.png)






.gif)


